PNAS:王建浩蒋鹏举课题组提出一种细菌感染防治新策略
王忆波 发布时间: 2020-03-04 访问次数: 1053
最近,王建浩蒋鹏举课题组与香港中文大学和山东大学合作,报道了一种抗菌新机制—Nck蛋白多肽抑制剂对EPEC引起的肠道细胞损伤的有效防治作用,相关成果近期在线发表于《PNAS》,论文题目“Safeguarding intestine cells against enteropathogenic Escherichia coli by intracellular protein reaction, a preventive antibacterial mechanism”,王建浩、蒋鹏举教授共同指导的16级硕士生赵远为论文共同第一作者,王建浩教授为论文第一通讯作者,香港中文大学夏江教授、山东大学李永强教授为论文共同通讯作者。《PNAS》是Proceedings of the National Academy of Sciences of the United States of America 缩写,它是美国国家科学院的院刊,亦是公认的世界四大名刊(Nature,Science,PNAS, Cell)之一,百年经典期刊(1915年创刊)。该篇论文的发表标志着我校科研团队在抗菌领域的相关前沿性研究工作受到了国际同行的认可和广泛关注。
人类在抗菌的过程中发展了各种的药物,但是随着耐药性的增加,需要依据新的机制和靶标来发展抗菌方法。致病性大肠杆菌(EPEC)会在很多地区引起人们的腹泻等疾病,目前主要用抗生素治疗,但是耐药性的出现以及新抗生素的缺乏仍是关键问题。
众所周知,EPEC在感染肠道细胞时,是通过Tir蛋白诱导被侵染细胞通过Nck接头蛋白的信号传导,引起细胞骨架蛋白发生重组形成底座,从而造成细胞损伤,引起腹泻等的严重的病理变化。通过多年的蛋白间相互作用以及多肽抑制剂的研究积累,联合课题组大胆推测如果可以找到理想蛋白结合位点,设计多肽与接头蛋白Nck结合,阻断细胞内信号传递,从而抑制EPEC对肠道细胞的黏附和损伤作用,将会成为一种崭新的抗菌策略,能有效的抑制细菌引起的感染,并且使细菌无法产生耐药性(图1)。

图1. 通过特异性阻断NCK-SH3.2结构域抑制EPEC感染。
经过大量的实验筛选,发现Nck-SH3.2片段中的第48位上的半胱氨酸的硫醇基团可以和来源于Sos1蛋白的带有亲电性的α-氯乙酰基团的多肽发生稳定不可逆的共价结合,形成硫酯键,此结合将有效的抑制细菌蛋白Tir所介导的机体肠道细胞骨架蛋白重组所造成的肠道细胞的损伤和肠道的病理变化(图2)。
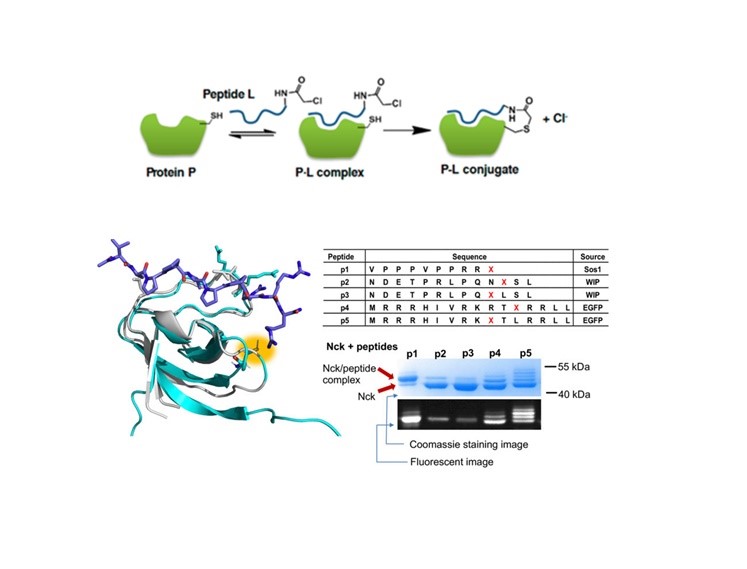
图2. Nck-SH3.2特异性反应性肽与体外和Caco-2细胞中的蛋白质-肽反应。
研究结果表明,不管是在体外研究还是体内研究,合成的多肽抑制剂P6都表现出了强有效的保护作用。首先从细胞实验中可以看到共价多肽抑制剂显著的抑制了细菌对Caco-2细胞的侵染作用。而小鼠实验进一步验证了多肽抑制剂的体内保护作用,通过提前预防性给药的小鼠,其粪便成固体状,和未感染EPEC的小鼠粪便一样,而没给药的小鼠出现了明显的腹泻现象(图3)。病理学分析发现细菌感染导致肠道不同部位出现了炎症反应、细胞凋亡、坏死、细胞增生等病理变化,而多肽抑制剂预处理下的小鼠,其肠道却并没有出现以上变化,这些现象都说明了Nck多肽抑制剂可以有效的预防EPEC对小鼠的侵染作用,为进一步的临床实验提供充足依据。
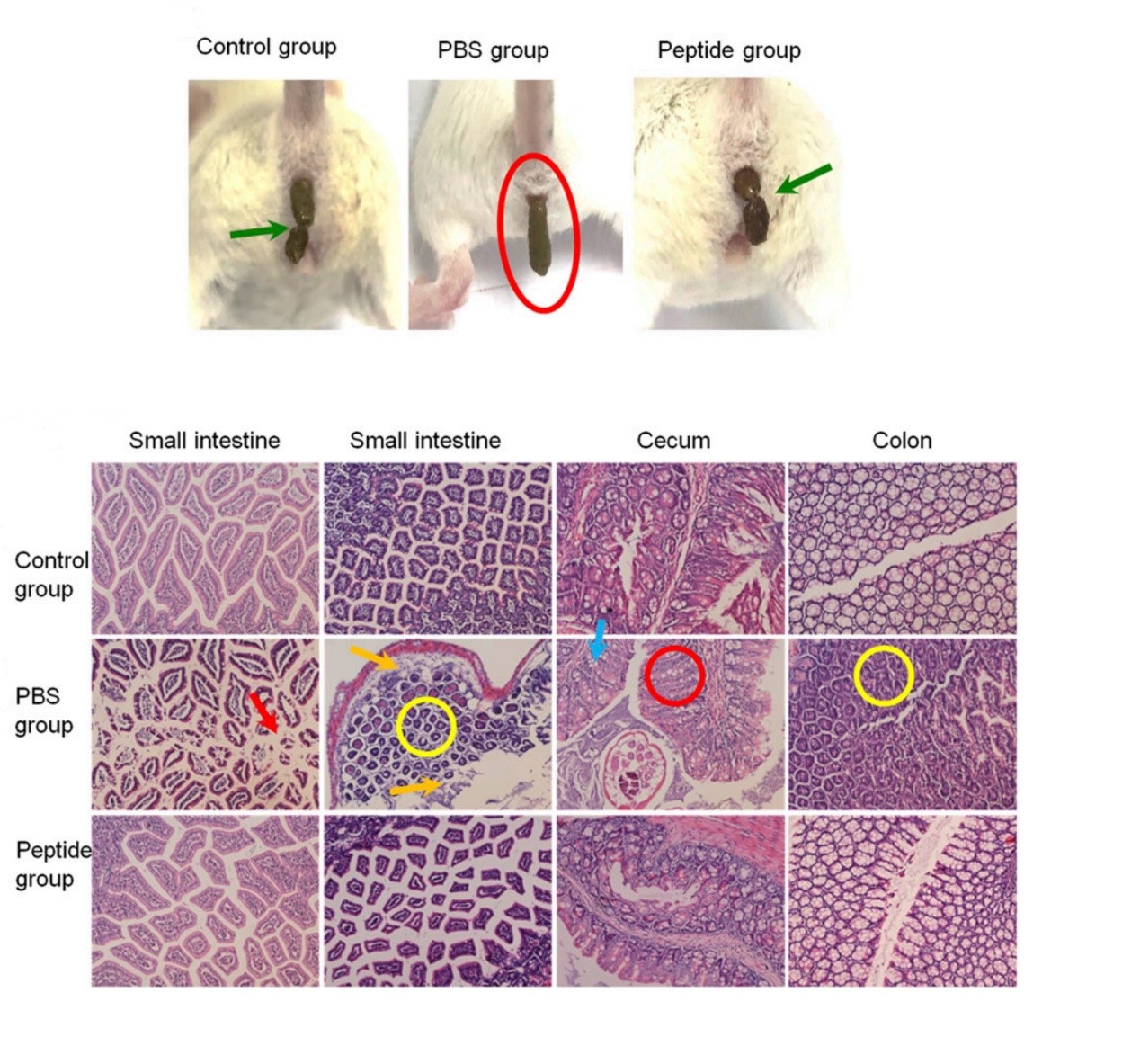
图3. 多肽抑制剂治疗保护小鼠免受EPEC感染。
经过不断的研究发现,通过蛋白之间的相互作用而达到抑制相关信号通路的传导,最终抑制细菌感染的抗菌新策略对细菌感染的预防和治疗具有重要意义,这种针对宿主细胞的抗菌思路有希望成为解决抗药性的有效方法。该工作已申请发明专利,并已与相关企业开展洽谈合作。
论文链接:https://www.pnas.org/content/early/2020/02/18/1914567117

