王佳胤博士在Org. Lett.上发表关于铜催化合成官能化1-茚酮的研究成果
发布时间: 2023-12-04 访问次数: 595
近日,张跃/严生虎团队在国际著名有机化学期刊Organic Letters(SCI一区)发表题为“Copper-Catalyzed Annulation-Trifluoromethyl Functionalization of Enynones”的研究论文,并被评为封面文章。王佳胤博士为论文第一作者及通讯作者,常州大学为第一署名单位。

茚酮是一类重要的碳环化合物,广泛存在于生物活性分子和天然产物中,重要的代表如Pterosin B and C, (+)-Indacrinone和Estrogen receptors (图1a)。此外,取代的1-茚酮因其在不对称合成和药物发现中的重要应用而引起了广泛的研究兴趣。到目前为止,已经发展了大量用于构建茚酮骨架的方法,包括传统的Friedel-Crafts酰基化、Heck-Larock环化和过渡金属催化的芳烃C(sp2)-H活化等方法。然而,这些经典方法具有反应条件苛刻和操作繁琐等缺点,因此,从合成实用性的角度来看,继续发展构建1-茚酮骨架的简单高效的方法是迫切需要的。
过去的十几年中,在贵金属催化剂(Rh、Pd等)的催化下,利用芳香族化合物和官能化的炔烃(邻位取代的苯甲醛、双取代的内芳烃)为底物,合成了各种官能化1-茚酮(图1b-i)。但是,当使用不对称取代的内炔烃时,较差的区域选择性限制了反应的合成实用性。最近,自由基串联反应由于在快速构建复杂的碳环和杂环骨架中的广泛应用而成为研究的热点。例如,利用自由基对碳碳三键进行加成,得到烯基自由基中间体,然后进行串联环化。因此,1-茚酮的构建可以由原位产生的自由基和含炔烃的底物一锅串联得到(图1b-ii)。基于文献调研和前人工作,我们设想利用烯炔类化合物为反应底物,使其与双官能化自由基试剂发生串联环化反应,实现1-茚酮骨架的二号位和三号位的同时双官能化,并实现全碳中心的构建和立体选择性的控制。
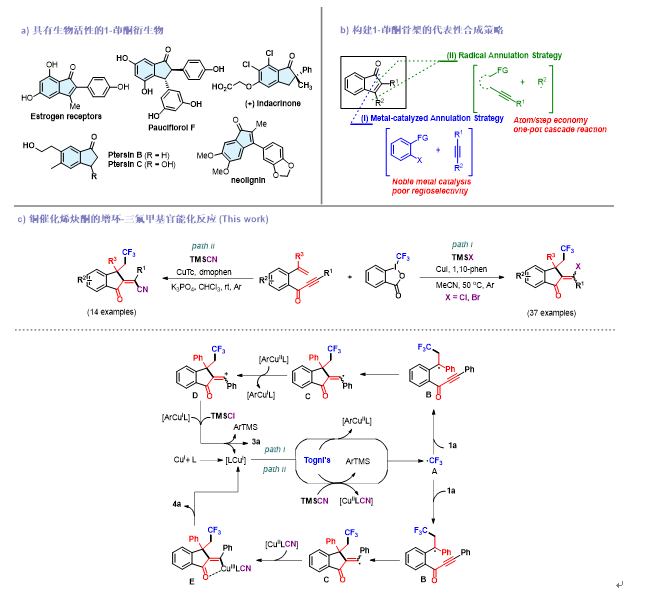
图1. 具有生物活性的1-茚酮衍生物及其合成策略
在本工作中,我们以烯炔酮为自由基受体,Togni’s试剂为自由基供体,在铜的催化下,分别以TMS卤化物和TMSCN为亲核型卤化试剂和氰基化试剂,实现了烯炔酮的增环-卤代三氟甲基化反应和增环-氰基三氟甲基化反应。该反应具有广泛的底物范围,并能应用于天然药物的后期修饰中,为快速构建官能化的1-茚酮骨架提供了一种实用且高效的方法,在大多数情况下,氯代和溴代三甲基硅烷转化为(E)-1-茚酮作为主要的立体异构体,而氰基三氟甲基化反应则以完全的立体选择性转化为(Z)-1-茚酮,产物的两种不同立体选择性取决于它们不同的反应途径。两种不同的反应过程都涉及氟烷基自由基加成、5-exo-dig环化等过程(图1c)。
文章链接:https://pubs.acs.org/doi/10.1021/acs.orglett.3c00679

